آشنایی با آزمایش پروستات و تفسیر آزمایش پروستات PSA
آزمایش PSA
تشخیص سرطان پروستات با آزمایش PSA
آزمایش PSA تستی است که باتوجه به نتایج آن وضعیت سلامتی پروستات در مردان بررسی خواهد شد. سرطان پروستات بیماری خاموشی است و به تدریج در بدن رشد میکند. این موضوع امتیازی برای بیمار است. چرا که اگر با استفاده از آزمایش PSA بیماری در مراحل ابتدایی تشخیص داده شود، روند درمان بهتر طی خواهد شد. اگر میخواهید بدانید این تست چرا و چگونه انجام میشود، مقاله زیر از را مطالعه کنید.
سرطان پروستات و آزمایش PSA
پروستات بخشی از دستگاه تناسلی مردان است که شامل آلت تناسلی، پروستات، وزیکولهای منی و بیضهها میشود. پروستات درست زیر مثانه و جلوی راست روده واقع شده است. اندازه آن به اندازه یک گردو است و مجرای ادرار (لولهای که ادرار را از مثانه تخلیه میکند) را احاطه کرده است. مایع تولید میکند که بخشی از مایع منی را تشکیل میدهد. برای بررسی احتمال سرطان پروستات پزشکان از آزمایش PSA استفاده میکنند.
آمارهای منتشر شده از آژانس بینالمللی تحقیقات سرطان نشان میدهد که سرطان پروستات دومین سرطان شایع مردان در جهان است (با نرخ بروز 29.3 و مرگ 7.6 در هر صد هزار نفر). سرطانهای ریه و روده بزرگ نیز به ترتیب در رتبههای اول و سوم قرار دارند. در حالت طبیعی اندازه غده پروستات با سن، افزایش مییابد در نتیجه با افزایش سن، خطر ابتلا به سرطان پروستات بیشتر میشود. این سرطان در مردان جوانتر از 50 سال، نادر است.
سرطان پروستات در ایران
سرطان پروستات با 6004 مورد جدید در جایگاه دوم شایعترین سرطانها در ایران بعد از سرطان معده قرار دارد. تعداد موارد مرگومیر این سرطان 3071 است که بعد از سرطانهای معده و ریه در جایگاه سوم قرار دارد.
درحالیکه علل اصلی سرطان پروستات هنوز ناشناخته مانده، خطر ابتلا به سرطان پروستات رو به افزایش است. اما داشتن یک یا چندین عامل خطر، بدین معنی نیست که حتماً به بیماری مبتلا خواهیم شد. تعدادی از این عوامل خطر عبارتاند از:
- سن: احتمال سرطان پروستات در مردان با سن کمتر از 40 سال، خیلی کم است. اما شانس داشتن سرطان پروستات در سنین بالاتر از 50 سال بهسرعت افزایش مییابد. حدود 6 مورد از 10 مورد سرطان پروستات در مردان بالاتر از 65 سال یافت میشود.
- نژاد/ قومیت: سرطان پروستات در سیاهپوستان بیشتر از مردان از نژادهای دیگر است. احتمال مرگ ناشی از سرطان پروستات در مردان سیاهپوست نیز بیش از دو برابر مردان سفیدپوست است.
- سابقه خانوادگی: به نظر میرسد سرطان پروستات در برخی از خانوادهها بیشتر اتفاق بیافتد، که نشان میدهد در برخی موارد ممکن است عوامل ارثی یا ژنتیکی وجود داشته باشد. احتمال بیماری در فردی که پدر یا برادرش مبتلا به سرطان پروستات باشند دو برابر سایر مردان است. همچنین احتمال داشتن سرطان پروستات در افراد با سابقه قوی خانوادگی سرطان پستان و تخمدان بیشتر از افراد بدون سابقه خانوادگی است.
- تغییرات ژنی: تعدادی از تغییرات ارثی ژن باعث افزایش ریسک سرطان پروستات میشود، اما بهطورکلی آنها احتمالاً برای تنها درصد کمی از موارد بهحساب میآیند.
علاوهبراین عوامل، عوامل دیگری مثل رژیمهای غذایی نامناسب، چاقی، استعمال دخانیات، قرار گرفتن در معرض مواد شیمیایی، وازکتومی… میتوانند بهعنوان عوامل فرعی بهحساب آیند.
آزمایش psa چیست و چه کاربردی دارد؟
آزمایش PSA موسوم به تست آنتی ژن اختصاصی پروستات (PSA) سطح PSA را در خون اندازهگیری میکند. PSA گلیکوپروتئینی است که توسط سلولهای طبیعی و همچنین بدخیم غده پروستات، تولید میشود. سطوح PSA در خون میتواند در مردان مبتلا به سرطان پروستات بیشتر باشد. سطح PSA همچنین ممکن است در سایر شرایطی که بر پروستات تأثیر میگذارد افزایش یابد.
سطح PSA اغلب در مردان مبتلا به سرطان پروستات، افزایش مییابد و آزمایش PSA در اصل توسط سازمان غذا و دارو (FDA) در سال 1986 برای نظارت بر پیشرفت سرطان پروستات، در مردانی که قبلاً این بیماری برایشان تشخیص داده شده بود، تأیید شد. در سال 1994،FDA استفاده از تست PSA همراه با معاینه دیجیتال رکتوم (DRE) را برای آزمایش مردان بدون علامت از نظر سرطان پروستات، تأیید کرد. مردانی که علائم پروستات را گزارش می کنند، اغلب تحت آزمایش PSA همراه با DRE قرار می گیرند تا به پزشکان در تشخیص ماهیت مشکل، کمک کنند.
علاوه بر سرطان پروستات، برخی از بیماری های خوش خیم (نه سرطانی) می توانند باعث افزایش سطح PSAدر مردان شوند
شایعترین بیماری خوشخیم پروستات که باعث افزایش سطح PSA میشود، پروستاتیت (التهاب پروستات) و هیپرپلازی خوشخیم پروستات (BPH) بزرگ شدن پروستات است. هیچ مدرکی وجود ندارد که نشان دهد پروستاتیت یا BPH میتواند منجر به بروز سرطان پروستات گردد، اما ممکن است که فردی به یکی از این دو بیماری مبتلا باشد و به سرطان پروستات نیز دچار شود.
این آزمایش که گاهی همراه با معاینه رکتال انجام میشود بهعنوان تست غربالگری برای سرطان پروستات استفاده میشود. از آنجا که علائم هشدار دهنده اولیه برای سرطان پروستات وجود ندارد تشخیص سرطان پروستات در مراحل اولیه و قبل از انتشار آن به سایر نقاط بدن از مهمترین مزایای غربالگری است که باعث آسانتر شدن و کوتاهتر شدن مراحل درمان میشود.
چه زمانی نیاز به انجام آزمایش psa داریم؟
متأسفانه، اغلب علائم هشداردهنده اولیه سرطان پروستات و بدون غربالگری منظم وجود ندارد. سرطان پروستات میتواند سالها ناشناخته باقی بماند. در برخی موارد، با رشد تومور ممکن است به مجرای ادراری فشار وارد کرده و جریان ادرار از مثانه را مسدود کرده و علائم ادرار را ایجاد کند. گاهی اوقات اولین علامت هشدار دهنده ممکن است وجود خون در ادرار باشد.
توجه: علائم تا زمانی که سرطان به مرحله پیشرفته نرسد ممکن است ظاهر نشوند.
اگر علائم زیر را دارید، حتماً فوراً به پزشک مراجعه کنید:
- تکرر ادرار (به خصوص در شب)
- جریان ضعیف ادرار
- ناتوانی در دفع ادرار
- قطع جریان ادرار (توقف و شروع)
- درد یا سوزش در هنگام ادرار کردن
- وجود خون در ادرار یا مایع منی
- مشکل در تخلیه کامل مثانه
- درد یا سوزش در هنگام ادرار کردن
- وجود خون در ادرار یا مایع منی
- درد در ناحیه کمر، لگن یا لگن که برطرف نمیشود
- انزال دردناک
تفسیر آزمایش psa
بهعنوان یک قاعده، هرچه سطح PSA در خون بیشتر باشد، احتمال وجود مشکل پروستات بیشتر است. علاوهبراین، افزایش مداوم سطح PSA در طول زمان نیز ممکن است نشانه سرطان پروستات باشد. اما عوامل زیادی مانند سن و نژاد میتوانند بر سطح PSA تأثیر بگذارند. برخی از غدد پروستات PSA بیشتری نسبت به بقیه تولید میکنند. سطح PSA همچنین میتواند تحت تأثیر عوامل زیر قرار گیرد:
برخی داروهای خاص
بزرگ شدن پروستات
عفونت پروستات
از آنجا که عوامل زیادی میتوانند بر سطح PSA تأثیر بگذارند، پزشک شما بهترین فرد برای تفسیر نتایج آزمایش PSA شما است. اگر آزمایش PSA غیرطبیعی باشد، پزشک ممکن است بیوپسی را برای اطلاع از سرطان پروستات توصیه کند.
رنج نرمال ان چقدر است؟
مقدار نرمال PSA در آزمایشگاههای مختلف رنج متفاوتی دارد. طبق نتایج آزمایشگاه دکتر شریفی حداکثر 7.2 میباشد. اما طی مطالعات، سطح خاصی بهعنوان طبیعی و غیرطبیعی برای PSA خون وجود ندارد و ممکن است با گذشت زمان، این مقدار در یک مرد تغییر کند. در گذشته، اکثر پزشکان سطح PSA 4.0 ng / mL و پایینتر را بهعنوان میزان طبیعی درنظر میگرفتند. بنابراین، اگر سطح PSA در بدن مردی بالاتر از 4.0 ng / mL باشد، پزشکان معمولاً نمونه برداری از پروستات را برای تعیین وجود سرطان، توصیه میکنند. با این حال، مطالعات اخیر نشان داده است که برخی از مردان با سطح PSA زیر 4.0 ng / mL، به سرطان پروستات مبتلا هستند و بسیاری از مردان با سطح بالاتر این آنتی ژن، سرطان پروستات ندارند.
علاوهبراین، عوامل مختلفی میتوانند سطح PSA را در مردان تغییر دهند. بهعنوان مثال، در صورت ابتلا به پروستاتیت یا عفونت ادراری، سطح PSA اغلب افزایش مییابد. نمونهبرداری از پروستات و جراحی پروستات نیز سبب افزایش سطح PSA میگردد. برعکس، مصرف برخی از داروها – از جمله فیناستراید (Proscar) و دوتاستراید (Avodart)، که برای درمان فشارخون استفاده میشوند – سطح PSA را کاهش میدهند. سطح PSA نیز ممکن است در آزمایشگاههای مختلف، تا حدودی متفاوت اندازهگیری شود. یکی دیگر از عوامل پیچیده، این است که مطالعات برای تعیین میزان طبیعی PSA در درجه اول در جمعیت مردان سفیدپوست انجام شده است. اگرچه نظرات متخصصان متفاوت است، اما برای توصیه به نمونهبرداری از پروستات، در مردانی از هر گروه نژادی یا قومی، سطح مشخصی از PSA وجود ندارد.
تفسیر نتایج آزمایش پروستات PSA
سرطان پروستات از جمله بیماریهایی است که مردان در سنین بالا با آن مواجه میشوند. البته احتمال بروز آن در مردان جوان نیز وجود داد. این بیماری بیشتر در مردان 70 تا 80 ساله رایج است. آزمایش PSAراهکاری موثری برای تشخیص زودهنگام این بیماری بهشمار میرود. اگر جزء گروههای پرخطر هستید و میخواهید خود را برای انجام این آزمایش حاضر کنید، مطالعه مقاله زیر را از دست ندهید. این مقاله برای بالا بردن آگاهی شما گردآوری شده است و نباید با تکیه بر آن وضعیت سلامتی خود را بررسی کنید.
آزمایش پروستات برای چیست؟
خون شامل دو نوع مختلف از آنزیم PSA است که یکی از آنها فرم کمپلکس نامیده میشود و دیگریfree PSA نام دارد. در آزمایش PSA، سطح هر دو نوع فرم اندازهگیری خواهد شد. مقادیر مختلف این آنزیم در آزمایش میتواند سطح سلامت پروستات را در آقایان مشخص کند.
در واقع اگر free PSA در آزمایش مقدار بالایی را نشان دهد، سرطان پروستات خوشخیم و اگر نشاندهنده مقدار پایینی باشد، سرطان بدخیم خواهد بود. ناگفته نماند که آزمایش free PSA در واقع یک آزمایش مکمل برای آزمایش total PSA خواهد بود.
نام دیگر آزمایش PSA، آزمایش پروستات است. چون همانطور که گفته شد، سطح آنتی ژنهای پروستات را اندازهگیری و خوشخیم یا بدخیم بودن سرطان پروستات را مشخص میکند.
شاید از خود بپرسید چه زمانی این تست تجویز خواهد شد؟ با بروز علائم زیر پزشک احتمالا این آزمایش را تجویز خواهد کرد:
- به وجود آمدن اختلال در انزال
- کم شدن نیرو در هنگام ادرار
- به وجود آمدن مشکل تخلیه ادرار
- احساس ناراحتی در ناحیه لگن
- بروز درد فراوان در استخوانها
- مشاهده خون در مایع منی
چرا آزمایش PSA تجویز میشود؟
این آزمایش ممکن است بهعنوان جزئی از آزمون چکاپ سالانه یا هنگام بروز علائم بیماری پروستات تجویز شود. این آزمایش مخصوصاً زمان ظاهر شدنعلائم سرطان پروستات اهمیت مییابد. ممکن است پزشک به دلایل زیر نیز این آزمایش را تجویز کند:
- سن: خطر ابتلا به سرطان پروستات بعد از گذست 50 سالگی بیشتر میشود. به همین دلیل مردان بهتر است بعد از 50 سالگی این تست را جدیتر بگیرند
- سابقه سلامت خانواده شما: اگر اعضای خانواده شما به سرطان پروستات مبتلا بودهاند، ممکن است بیش از دیگران در معرض خطر سرطان باشید
- در فرایند درمان سرطان پروستات: اگر سرطان پروستات داشته باشید ممکن است پزشک شما برای نظارت بر وضعیت شما یا برای دریافت بازخورد از نتایج درمان از آزمایش PSA استفاده کند
بهترین سن برای انجام آزمایش PSA
تصمیمگیری در مورد انجام این تست باید با مشورت پزشک انجام شود. ضرورت انجام آزمایش PSA با توجه به سن افراد متفاوت است. انجمن اورولوژی آمریکا پیشنهاد میکند گروههای مختلف سنی به شرح زیر نسبت به انجام این آزمایش اقدام کنند:
- مردان زیر 40 سال: بدون نیاز به آزمایش
- مردان 40 تا 54 سال: اگر در معرض خطر باشید انجام آن لازم است
- 55 تا 69 سال: توصیه میشود که به صورت غربالگری آن را انجام دهید
بهترین زمان برای انجام آزمایش PSA
زمانی که قصد دارید آزمایش دهید باید حداقل 24 ساعت از رابطه جنسی شما گذشته باشد. زیرا شرایط انزال میتواند میزان PSA در خون شما را افزایش دهد و باعث ایجاد نتایج کاذب شود. علاوه بر این، بعضی داروها ممکن است بر نتایج آزمایش شما تأثیر بگذارند، بنابراین هر دارویی که مصرف میکنید به پزشک خود اطلاع دهید. برای انجام این تست نیازی به ناشتایی نیست. وبسایت mayoclinic در مورد خطرات انجام تست PSA میگوید:
این آزمایش بهخودیخود خطر اصلی ندارد و فقط شامل یک آزمایش خون است. خطرات احتمالی بیشتر مربوط به سایر معاینات و آزمایشهایی است که معمولاً در کنار این آزمایش تجویز میشود. بهعنوان مثال در صورت بروز علائم بیماری سرطان ممکن است بهنمونهبرداری از پروستات نیز نیاز باشد. نمونهبرداری میتواند عوارضی جون درد، خونریزی یا عفونت را به همراه داشته باشد.
ازآنجاکه این تست میتواند با نتایج کاذب نیز روبرو باشد؛ درصورتیکه میزان PSA در آزمایش خون شما بالا باشد درحالیکه به سرطان مبتلا نباشید؛ ممکن است باعث اضطراب یا پریشانی شما شود. اگر سرطان پروستات در شما تشخیص داده شود ولی تومور رشد آهستهای داشته باشد که منجر به عوارضی در شما نشود، ممکن است فقط باعث شود که اضطراب قابلتوجهی را تجربه کنید.
مقدار نرمال و بحرانی PSA در آزمایش خون
بد نیست بدانید برای اندازهگیری مقدار آنزیم PSA، به نمونه خون نیاز است. اگر مقادیر PSA در آزمایش خون خارج از حد نرمال را نشان دهد، خطرناک خواهد بود. این مقادیر نشاندهنده میزان آنتی ژنهای پروستات است.
البته گاهی ممکن است این مقدار تحت تاثیر عوامل مداخلهگر قرار بگیرند و نتیجه آزمایش را مختل کنند که در این صورت، آزمایش دوباره تکرار خواهد شد. مقدارنرمال PSA در مردان با توجه به سن طبق جدول زیر است:
| سن | مقدار PSA در آزمایش خون |
| کمتر از 40 سال | کمتر از 1.7 |
| بین 40 تا 50 سال | کمتر از 2.2 |
| بین 50 تا 60 سال | کمتر از 3.4 |
| بین 60 تا 70 سال | کمتر از 6.16 |
| بیشتر از 70 سال | کمتر از 6.77 |
زمانی که PSA در خون خارج از محدوده نرمال قرار بگیرد، بحرانی تلقی میشود و نیاز به درمان دارد. البته لازم به ذکر است که با افزایش سن، مقدار PSA خون افزایش پیدا میکند و این موضوع به عنوان یک امرطبیعی مطرح میشود و اصلا جای نگرانی ندارد.
تفسیر آزمایش PSA
درست است که نمیتوانید آزمایش PSA را به خوبی پزشک متخصص تفسیر کنید، اما بد نیست بدانید که بالا یا پایین رفتن مقدار PSA در آزمایش خون نشاندهنده چیست؟
در صورتیکه نتیجه آزمایش PSA در محدوده نرمال نباشد، احتمال بروز بیماریهای زیر وجود دارد:
- سرطان پروستات بدخیم یا خوشخیم
- التهاب پروستات
- بزرگی پروستات
- عفونت پروستات
علائم بالا یا پایین بودن فاکتور آزمایش PSA
زمانی که فاکتور آزمایش PSA بالا یا پایین باشد، علائم و نشانههایی در شخص بروز میکند. این علائم شامل موارد زیر میشوند:
- مشکلات تخلیه ادرار
- وجود خون در ادرار و مایع منی
- اختلالات انزال
- درد و ناراحتی در ناحیه لگن
دلایل بالا بودن PSA در آزمایش خون
اگرچه بالا بودن میزان PSA میتواند به دلیل سرطان پروستات رخ دهد، اما علاوه بر سرطان پروستات، عوامل زیر نیز میتواند باعث افزایش آن شود:
- عفونت: التهاب و عفونت دستگاه ادراری (UTI) و دیگر عفونتهای مجاری دفع ادرار میتواند باعث افزایش میزان PSA شوند
- معاینه رکتوم: ازآنجاییکه معاینه رکتوم (DRE) ممکن است باعث افزایش موقت میزان PSA شود، معمولاً بعد از آزمایش PSA انجام میشود
- رابطه جنسی: در برخی موارد، ارگاسم در 24 ساعت پیش از آزمایش میتواند باعث افزایش PSA شود
- تومور خوشخیم پروستات (BPH): تومورهای خوشخیم به بزرگ شدن غده پروستات منجر میشود. این عارضه سرطانی نیست، اگرچه ممکن است علائم متعددی ازجمله انسداد ادرار و افزایش PSA را ایجاد کند
- آسیب یا جراحی: آسیب یا جراحی ساختارهای نزدیک پروستات و رکتوم، میتواند باعث افزایش PSA شود
- PSA حساس: در بعضی مردان، PSA بهطور عادی و بدون مشکل خاصی بالا و پایین میرود
- سن: میزان PSA اغلب مردان بهمرور زمان بهتدریج افزایش مییابد
آیا سرطان پروستات با آزمایش PSA قابل تشخیص است؟
اندازهگیری PSA در آزمایش خون برای غربالگریسرطان پروستات استفاده میشود. غربالگری سرطان پروستات به معنای جستجوی علائم این بیماری قبل از شدید شدن آن است. اما باید گفت مثبت شدن نتایج این آزمایش همیشه به این معنی نیست که به سرطان مبتلا هستید.
اگر نتایج این تست مثبت شود احتمال وجود سرطان افزایش مییابد و به آزمایشهای بیشتری نیاز دارید تا بتوان در مورد سرطان قضاوت کرد. مقدار PSA در سرطان پروستات با توجه به سن متفاوت خواهد بود. برای افراد بین 50 تا 60 سال مقادیر بیش از 3.5 ng/ml میتواند بالا در نظر گرفته شود.
بیشتر سرطانهای پروستات بهکندی رشد میکنند و فراتر از پروستات گسترش نمییابند؛ به همین علت ممکن است هیچگاه مشکلاتی برای سلامتی فرد ایجاد نکنند. بسیاری از افراد با وجود سرطان پروستات تا پایان عمر متوجه آن نمیشوند. بااینحال آزمایشهای تشخیصی بیشتر میتواند به درک نوع سرطان شما کمک کند.
شرایط آزمایش PSA
برای انجام آزمایش PSA به نکات زیر دقت کنید:
- برای این تست پیشنهاد میشود 8 تا 12 ساعت ناشتا باشید
- 48 تا 72 ساعت قبل از انجام آزمایش، فعالیت شدید بدنی، معاینه مقعدی پروستات و انزالنداشته باشید
تست های مرتبط با آزمایش PSA
ممکن است پزشکان برای تایید تشخیص و شروع درمان، آزمایشهای متعددی را در کنار تست PSA پیشنهاد کنند. با این حال میتوان گفت آزمایش free PSA تنها ترین تست مرتبط به این آزمایش است.
کدام بیماریهای زمینهایی بر نتیجه آزمایش PSA تاثیر می گذارند؟
همه مسائل مربوط به درمان که قرار است بعد از انجام آزمایش PSA انجام بگیرد، به نتایج این آزمایش و مقادیری که نشان میدهد، بستگی دارد. گاهی اوقات فرد مبتلا به بیماریهای پیش زمینهای است و باید راجع به آن با پزشک صحبت کند. چون برخی بیماریهای پیش زمینهای در فاکتور آزمایشی PSAاختلال ایجاد میکنند و به نوعی باعث افزایش یا کاهش مقادیر PSA در خون خواهند شد. این بیماریهای پیش زمینهای عبارتند از:
- سرطان پروستات
- هایپر پلازی پروستات (انسداد ادراری)
- آنفارکت پروستات
البته تنها افزایش فاکتور آزمایشی PSA است که خطرناک تلقی میشود. کاهش آن زمینهساز هیچ بیماری نخواهد بود.
نگارش و گردآورنده: رضا رحیمی
منابع مقاله:
https://cdc.gov/cancer/prostate/basic_info/diagnosis.htm
https://dr-valipour.com/2522/psa
https://prostateconditions.org/
webmd، kasraeianurology، medlineplus، mayoclinic
- ادامه مطلب
تاریخ: پنجشنبه , 16 آذر 1402 (22:44)
- گزارش تخلف مطلب













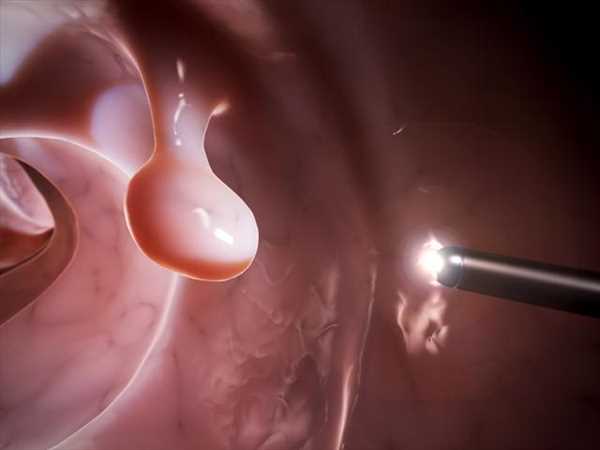



 هموروئید یا همان بواسیر ممکن است دردهایی را در ناحیه روده و مقعد ایجاد کند. گاها این بیماری با خون در مدفوع یا بدون خونریزی بروز می کند. به همین دلیل به محض مشاهده علائم درد شکم و ناحیه روده مقعد به متخصص جراحی عمومی و لیزر مراجعه کنید تا وضعیت شما را از هر لحاظ بررسی کنند.
هموروئید یا همان بواسیر ممکن است دردهایی را در ناحیه روده و مقعد ایجاد کند. گاها این بیماری با خون در مدفوع یا بدون خونریزی بروز می کند. به همین دلیل به محض مشاهده علائم درد شکم و ناحیه روده مقعد به متخصص جراحی عمومی و لیزر مراجعه کنید تا وضعیت شما را از هر لحاظ بررسی کنند. داروهای ضد التهاب مانند ناپروکسن برای کاهش درد استفاده کند.
داروهای ضد التهاب مانند ناپروکسن برای کاهش درد استفاده کند.